Los analgésicos, como todo medicamento, están compuestos de ciertas sustancias: los principios activos: son los que reaccionan y producen el efecto del medicamento (casi siempre se trata de ácido acetil salicílico) y los excipientes, que son sustancias que no reaccionan y cuyas funciones son de relleno, para estabilizar el medicamento... si función verdaderamente vital para el medicamento (suele tratarse de almidón o lactosa).
OBJETIVO
Comprobar la presencia de ác
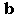 ido acetil salicílico en algunos analgésicos de uso frecuente, relacionar la presencia de acetil salicílico con algunas de las propiedades de estos comprimidos analgésicos y analizar el excipiente de los comprimidos investigados.
ido acetil salicílico en algunos analgésicos de uso frecuente, relacionar la presencia de acetil salicílico con algunas de las propiedades de estos comprimidos analgésicos y analizar el excipiente de los comprimidos investigados.MATERIAL EMPLEADO
Comprimidos analgésicos de diversas marcas, tubos de ensayo, vasos de precipitado, mechero de gas, gradilla, nitrato de hiero (III), reactivo de Fehling, reactivo de lugol, papel indicador de pH, agua destilada, etiquetas autoadhesivas, matraz aforado(100 ml), balanza, vidrio reloj, espátula, mortero y mazo, pipeta y émbolo.
MÉTODO
Tras preparar una muestra de 0.1 molar de nitrato de hierro (III) en un matraz aforado de 100ml machacamos en un mortero con un mazo las distintas muestras de los 3 analgésicos (2 unidades de cada analgésico), hecho esto pesamos 0.5g de cada muestra y las diluimos en 100 ml de agua destilada. Tras acabas este paso vemos que, mientras la muestra A es muy difícil de disolver en agua (incluso queda con grumos), la B se diluye en un momento por ser efervescente y la C se diluye bien (aunque no del todo, la disolución queda un poco blanca). Tras esto medimos el pH de cada disolución (que vemos que son todas ácidas entre 6 y 7, menos la A que está entre 2 y 3), después cogemos 3ml de cada disolución y los ponemos en tubos de ensayo distintos y diferenciados con etiquetas, a estos tubos con las muestras les añadimos otros 3ml de nitrato de hierro (III) que se coloran de azul en presencia de salicílico, así descubrimos que la muestra A es la única sin acetil salicílico, además en la B hay un componente extraño que se precipita (aparentemente almidón). Tras esto intentamos ver los excipientes de cada una, para empezar usamos lugol para detectar almidón (rehacemos el proceso de los 3ml de cada muestra en diferenciados tubos de ensayo) y vemos que la única con almidón es la C, pero en cantidades muy escasas, y para acabar a cada muestra de 3ml le añadimos 2ml de cada disolución de cada Fehling (A y B) y calentándolas al baño maría para comprobar si tienen un excipiente disacárido con poder reductor (lactosa), tras esto vemos que ninguna reacciona.
CONCLUSIÓN
En las muestras que hemos analizado hemos visto que: la A (termalgin) no contenía ácido acetil salicílico, no contenía almidón ni lactosa; la B (Couldina) contenía acetil salicílico y nada de almidón ni lactosa; y por último la C (aspirina) contenía salicílico también, algo de almidón y nada de lactosa.